La catálisis supramolecular es una disciplina que hace referencia a la aplicación de la química supramolecular en el ámbito de la catálisis. La química supramolecular tiene sus bases en interacciones no covalentes entre moléculas, es decir, interacciones débiles a partir de las cuales diferentes moléculas se reconocen y fuerzan una determinada interacción entre ellas.
Algunas de estas interacciones son el enlace de hidrógeno (también llamados puentes de hidrógeno), las interacciones metal-ligando, o los enlaces de Van der Waals.
La catálisis supramolecular se inspira en el funcionamiento de los sistemas enzimáticos. Las enzimas son catalizadores de reacciones químicas que tienen lugar en los organismos vivos. La catálisis supramolecular funciona como la catálisis enzimática pero el catalizador no es una enzima (un complejo proteico y por tanto una molécula muy difícil de sintetizar) sino una molécula más sencilla que simula la función.
Los catalizadores supramoleculares basan su efectividad en tres mecanismos de acción:
- Orientación de grupos reactivos: actúan haciendo que los grupos reactivos de las moléculas que han de reaccionar, estén más cerca el uno del otro y por lo tanto, reaccionen más fácilmente.
- Aumento de la concentración efectiva del sustrato: la velocidad de una reacción química depende de la concentración de los reactivos, y por tanto, una manera de acelerar una reacción es aumentando la concentración de los reactivos, por ejemplo, confinándoles en un espacio reducido, encapsulando los mismos en una molécula-caja que actúa como catalizador.
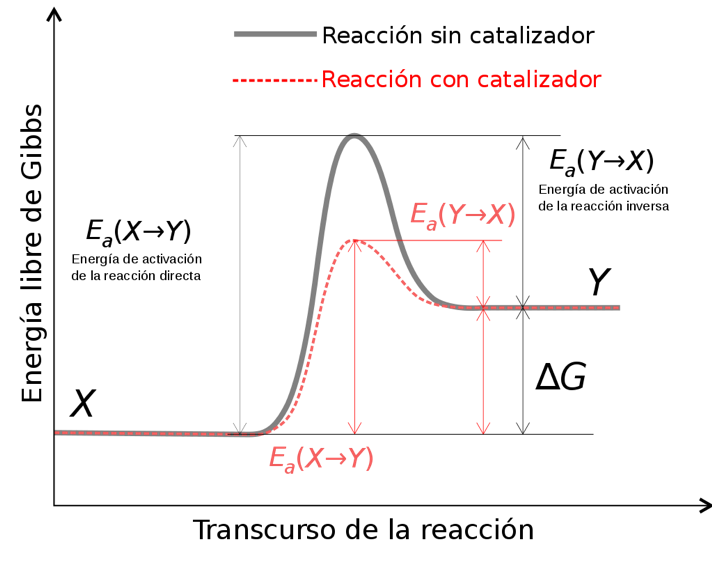
- Estabilización del estado de transición y reducción de la energía de activación de la reacción: La energía de activación de una reacción es una barrera energética que hay que superar para que los reactivos se conviertan en productos.