La catàlisi supramolecular és una disciplina que fa referència a l’aplicació del la química supramolecular en l’àmbit de la catàlisi. La química supramolecular té les seves bases en interaccions no covalents entre molècules, és a dir, interaccions febles a partir de les quals diferents molècules es reconeixen i forcen una determinada interacció entre elles.
Algunes d’aquestes interaccions són l’enllaç d’hidrogen (també anomenats ponts d’hidrogen), les interaccions metall-lligand, o els enllaços de Van der Waals.
La catàlisi supramolecular s’inspira en el funcionament dels sistemes enzimàtics. Els enzims són catalitzadors de reaccions químiques que tenen lloc als organismes vius. La catàlisi supramolecular funciona com la catàlisi enzimàtica però el catalitzador no és un enzim (un complex proteic i per tant una molècula molt difícil de sintetitzar) sinó una molècula més senzilla que en simula la funció.
Els catalitzadors supramoleculars basen la seva efectivitat en tres mecanismes d’acció:
- Orientació de grups reactius: actuen fent que els grups reactius de les molècules que han de reaccionar, estiguin més a prop l’un de l’altre i per tant, reaccionin més fàcilment.
- Augment de la concentració efectiva del substrat: la velocitat d’una reacció química depèn de la concentració dels reactius, i per tant, una manera d’accelerar una reacció és augmentant la concentració dels reactius, per exemple, confinant-los en un espai reduït, encapsulant-los dins una molècula-capsa que actua com a catalitzador.
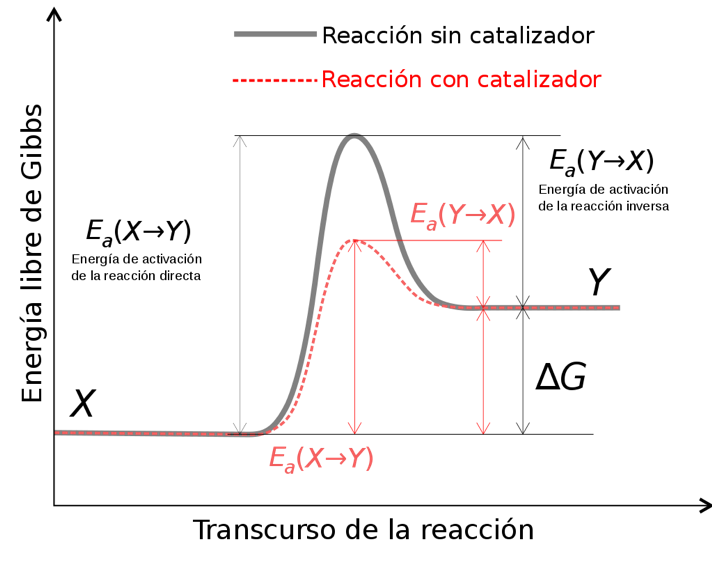
- Estabilització de l’estat de transició i reducció de l’energia d’activació de la reacció: L’energia d’activació d’una reacció és una barrera energètica que cal superar per tal que els reactius es converteixin en productes.